Tavola periodica: FAQ interessanti
La tavola periodica è uno strumento fondamentale nel mondo della chimica.
Organizza tutti gli elementi conosciuti in base alle loro proprietà atomiche e chimiche, permettendo di comprendere in modo visivo e sistematico il loro comportamento e le loro relazioni. Dagli studenti ai professionisti di laboratorio, la tavola periodica facilita l’interpretazione delle reazioni, la formulazione dei composti e la predizione delle proprietà. In questa sezione raccogliamo domande curiose e interessanti che aiutano a scoprire aspetti poco noti della sua storia, classificazione e protagonisti.
Quante persone hanno collaborato a elaborare ciò che oggi conosciamo come tavola periodica?
Nel XIX secolo si conoscevano 63 elementi, ma la mancanza di consenso sulla loro disposizione portò al Primo Congresso Internazionale dei Chimici a Karlsruhe, in Germania, nel 1860. Qui Stanislao Cannizzaro presentò il concetto di “peso atomico”, che influenzò Mendeleev e altri nell’organizzazione degli elementi, ponendo le basi per la tavola periodica moderna.
Oltre a Mendeleev, altri scienziati come Jabir ibn Hayyan, Lavoisier e Marguerite Perey contribuirono allo sviluppo della tavola periodica. Oggi la tavola include 118 elementi.
Quanti elementi contiene la tavola periodica? Come si classificano? Mettiamo un po’ d’ordine!
Un aspetto affascinante della Tavola Periodica è la sua capacità di evolversi nel tempo. Ogni nuovo elemento scoperto richiede l’aggiornamento della tavola, rendendola uno strumento dinamico che riflette il continuo progresso del sapere scientifico. Questa caratteristica fa della tavola periodica non solo un catalogo della materia, ma anche una rappresentazione del progresso della scienza.
Lo sapevi?
Il modo in cui gli elementi sono ordinati consente di predire le loro proprietà e reattività, persino per elementi ancora da scoprire.
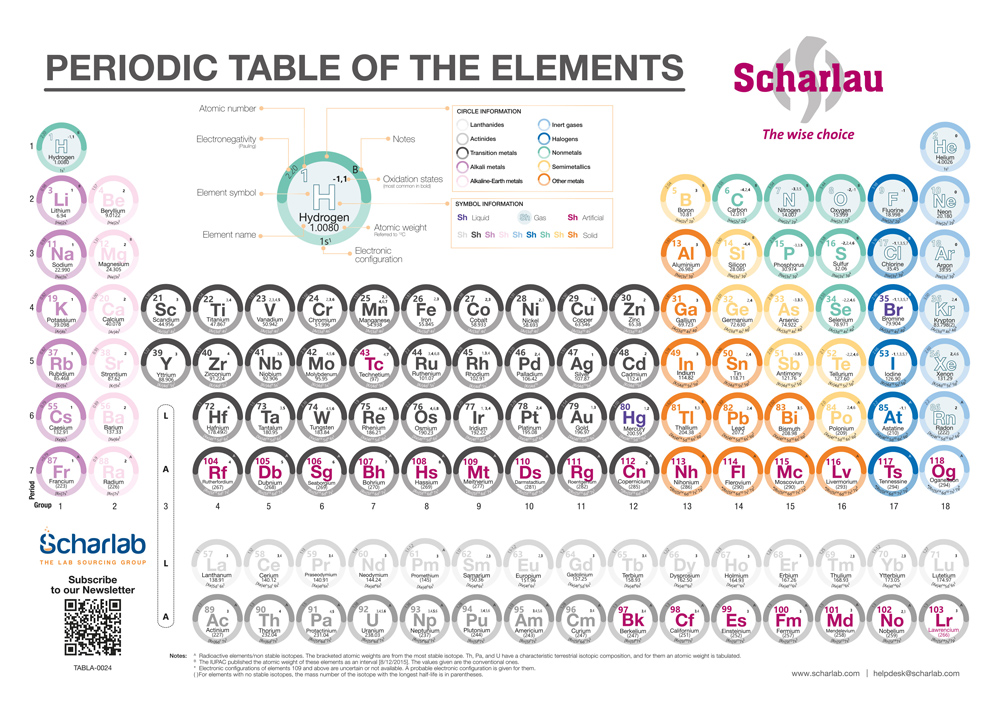
I 118 elementi della Tavola Periodica sono organizzati in colonne (gruppi) e righe (periodi), e si suddividono in Metalli, Metalloidi e Non Metalli. La loro distribuzione si basa sul numero atomico e sulla configurazione elettronica, il che ne facilita la comprensione e l’ordinamento. Ci sono 18 gruppi; gli elementi all’interno di ciascun gruppo condividono proprietà fisiche e chimiche simili grazie alla configurazione elettronica. Il periodo indica il numero di gusci elettronici.
Nella tavola periodica realizzata da Scharlab ogni gruppo di elementi ha un colore distinto. Ad esempio, i metalli sono di colore grigio scuro.

I Metalli
I Metalli sono i più abbondanti e si suddividono in sei sottogruppi:
- Alcalini (colonna 1)
- Alcalino-terrosi (colonna 2)
- Metalli di transizione/Blocco D (colonne 3–12)
- Lantanidi (riga 6)
- Attinidi (riga 7)
- Altri metalli (colonne 13–16)
I Metalloidi
I Metalloidi sono sette, distribuiti tra le colonne 13 e 16.

I Non Metalli
I Non Metalli si suddividono in:
- Altri non metalli (colonne 14–16)
- Alogeni (colonna 17)
- Gas nobili (colonna 18)
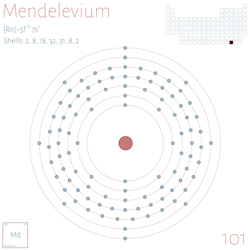
Lo sapevi che esiste un elemento chiamato mendelevio? Conosci le sue caratteristiche peculiari?
Sì, hai indovinato: il nome mendelevio deriva da Mendeleev, il creatore della tavola periodica.
Il mendelevio è un elemento sintetico con simbolo Md e numero atomico 101. Appartiene alla serie degli attinidi ed è un elemento transuranico (più pesante dell’uranio), il che significa che non si trova naturalmente sulla Terra e deve essere prodotto in laboratorio.
Il mendelevio è stato scoperto nel 1955 da un gruppo di scienziati guidato da Albert Ghiorso, Glenn T. Seaborg, Bernard G. Harvey e Gregory R. Choppin presso l’Università della California, Berkeley. Fu creato bombardando un bersaglio di einsteinio-253 con particelle alfa (nuclei di elio) in un acceleratore di particelle. Il nome fu scelto in onore di Dmitri Mendeleev, creatore della tavola periodica.
Sebbene il suo aspetto esatto non sia noto, si ritiene che possa essere metallico e di colore argenteo, come altri attinidi. Il mendelevio non ha isotopi stabili. Il suo isotopo più comune è il mendelevio‑256, con una vita media di circa 1,17 ore, che decade attraverso disintegrazione alfa. A causa della sua breve vita media, tutti gli isotopi del mendelevio si disintegrano rapidamente, rendendo difficile il loro studio e utilizzo. La produzione è così complessa che solo pochissimi atomi vengono sintetizzati per esperimento!
Quanti elementi sono stati scoperti da donne?

Il Francio (Fr) è stato scoperto da Marguerite Perey nel 1939 mentre studiava la disintegrazione dell’attinio presso l’Istituto Curie di Parigi. È un metallo alcalino, numero 87 nella tavola periodica.

Il Radio (Ra) e il Polonio (Po) furono scoperti da Marie Curie e Pierre Curie nel 1898. Marie Curie è stata pioniere nello studio della radioattività e ha ricevuto due Premi Nobel per le sue ricerche. Questi elementi radioattivi furono fondamentali per lo sviluppo della scienza nucleare.
Oltre a Perey e Curie, molte altre donne hanno contribuito in modo significativo allo sviluppo della tavola periodica e alla comprensione degli elementi, anche se non sempre hanno ricevuto il riconoscimento dovuto:

Ida Noddack, chimica tedesca, co‑scoprì l’elemento Renio (Re) nel 1925 insieme al marito Walter Noddack. Propose anche il concetto di fissione nucleare, sebbene la sua teoria non fosse accettata in quell’epoca.

Lise Meitner, fisica austriaca, collaborò con Otto Hahn nella ricerca sulla fissione nucleare. Il suo lavoro fu fondamentale per la comprensione della disintegrazione nucleare, portando alla scoperta del Tecnezio (Tc). Sebbene Hahn abbia ricevuto il Premio Nobel per la Chimica nel 1944, Meitner ne fu ingiustamente esclusa.

Harriet Brooks fu tra le prime donne a studiare la radioattività e collaborò con Ernest Rutherford. Contribuì in modo significativo allo studio degli elementi radioattivi come il radio e il torio, anche se non fu mai riconosciuta ufficialmente come scopritrice di alcun elemento.

Darleane Hoffman e il suo team sintetizzarono il Seaborgio (Sg) negli anni ’90, confermando l’esistenza di elementi transuranici e contribuendo al loro riconoscimento nella tavola periodica.